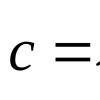Марганец содержится во всех видах стали и чугуна. Способность марганца давать сплавы с большинством известных металлов используется для получения не только различных сортов марганцевой стали, но и большого числа нежелезных сплавов (манганинов). Из них особенно замечательными являются сплавы марганца с медью (марганцевая бронза). Она, подобно стали, может закаляться и в то же время намагничиваться, хотя ни марганец, ни медь не обнаруживают заметных магнитных свойств.
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится тверже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
По принятым в нашей стране стандартам все элементы, легирующие сталь, имеют «собственную» букву. Так, в марку стали, содержащей кремний, обязательно входит буква С, хром обозначается буквой X, никель - буквой Н, ванадий - буксой Ф, вольфрам - буквой В, алюминий - буквой Ю, молибден - буквой М. Марганцу присвоена буква Г. Лишь углерод буквы не имеет, и у большинства сталей цифры в начале марки означают его содержание, выраженное в сотых долях процента. Если за буквой нет никаких цифр, то, значит, элемент, обозначенный этой буквой, содержится в стали в количестве около 1%. Расшифруем для примера состав конструкционной стали 30ХГС: индексы показывают, что в ней 0,30% углерода, 1% хрома, 1% марганца и 1% кремния.
Марганец обычно вводят в сталь вместе с другими элементами - хромом, кремнием, вольфрамом. Однако есть сталь, в состав которой, кроме железа, марганца и углерода, ничего не входит. Это так называемая сталь Гадфилда. Она содержит 1...1,5% углерода и 11...15% марганца. Сталь этой марки обладает огромной износостойкостью и твердостью. Ее применяют для изготовления дробилок, которые перемалывают самые твердые породы, деталей экскаваторов и бульдозеров. Твердость этой стали такова, что она не поддается механической обработке, детали из нее можно только отливать.
Применение марганца для очистки металла от серы.
Сера - элемент, безусловно, полезный. Но не для металлургов. Попадая в чугун и сталь, она становится чуть ли не самой вредной примесью. Сера активно реагирует с железом, и сульфид FeS снижает температуру плавления металла. Из-за этого во время прокатки на раскаленном металле появляются разрывы и трещины.
В металлургическом производстве удаление серы возложено на доменщиков. «Связать», превратить в легкоплавкое соединение и удалить серу из металла легче всего в восстановительной атмосфере. Именно такая атмосфера создается в доменной печи. Но сера и вносится в металл при доменной плавке вместе с коксом, который обычно содержит 0,7...2% серы. Чугун, выпускаемый в нашей стране, должен содержать не более 0,05% серы, а на передовых заводах этот предел снижен до 0,035% и даже меньше.
Марганец вводят в доменную шахту именно для того, чтобы удалить серу из чугуна. Сродство к сере у марганца больше, чем у железа. Элемент №25 образует с ней прочный легкоплавкий сульфид MnS. Сера, связанная марганцем, переходит в шлак. Этот способ очистки чугуна от серы прост и надежен.
Способность марганца связывать серу, а также ее аналог - кислород широко используется и в производстве стали. Еще в прошлом веке металлурги научились плавить «зеркальный» чугун из марганцовистых железных руд. Этот чугун, содержащий 5...20% марганца и 3,5...5,5% углерода, обладает замечательным свойством: если его добавить к жидкой стали, то из металла удаляются кислород и сера. Изобретатель первого конвертора Г. Бессемер использовал зеркальный чугун для раскисления и науглероживания стали.
В 1863 г. на заводе «Фонике» в Глазго было организовано производство ферромарганца - сплава марганца с железом. Содержание элемента №25 в таком сплаве 25...35%. Ферромарганец оказался лучшим раскислителем, чем зеркальный чугун. Сталь, расклсленная ферромарганцем, становится гибкой, упругой.
Сейчас получают ферромарганец, содержащий 75...80% Мn. Этот сплав, выплавляют в доменных и электросталеплавильных дуговых печах и широко применяют для производства марганцовистых сталей, речь о которых еще впереди.
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом (усиливающимся под давлением). Теллурид марганца перспективный термоэлектрический материал (термо-э.д.с 500 мкВ/К).
Интересными свойствами обладает сплав, называемый нормальным манганином, содержащий 11- 13% марганца, 2,5-3,5% никеля и 86% меди. Отличаясь высоким электросопротивлением и малой термоэлектродвижущей силой в паре с медью, этот сплав особенно пригоден для изготовления катушек сопротивления. Способность манганина изменять сопротивление в зависимости от давления, под которым находится сплав, используется при изготовлении электрических манометров. В самом деле, чем измерить давление, например, в 15-25-30 тыс. атмосфер? Никакой обычный манометр не может выдержать такого давления. Жидкость или газ вырываются сквозь стенки трубки, как бы прочны они ни были, с силою взрыва. Иногда даже не удается найти микроотверстий, через которые прорывается содержимое манометрической трубки. В этих случаях манганин является незаменимым. Измеряя электрическое сопротивление манганина, находящегося под определяемым давлением, можно по заранее вычерченному графику зависимости сопротивления от давления вычислить последнее с любой степенью точности.
Из соединений марганца, нашедших применение в практической деятельности человека, следует указать на двуокись марганца и марганцевокислый калий (перманганат калия), наиболее известный, особенно у медиков, под названием "марганцовки". Двуокись марганца находит применение в гальванических элементах типа Лекланше, получении хлора, приготовлении каталитических смесей (гопкалит в противогазах). Марганцевокислый калий широко применяется в медицине как антисептическое средство для промывания ран, смазывания ожогов и т. д., для промывания желудка при отравлении фосфором, алкалоидами, солями синильной кислоты. Также широко применяется перманганат калия в химии при аналитических исследованиях, получении хлора, кислорода и др.
Впрочем, марганцем улучшают свойства не только железа. Так, сплавы марганца с медью обладают высокой прочностью и коррозионной стойкостью. Из этих сплавов делают лопатки турбин, а из марганцовистых бронз - винты самолетов и другие авиадетали.
Применение диоксида марганца и перманганата калия
Диоксид марганца используют в качестве катализатора в процессах окисления аммиака, органических реакциях и реакциях разложения неорганических солей. В керамической промышленности MnO2 используют для окрашивания эмалей и глазурей в черный и тёмно-коричневый цвет. Высокодисперсный MnO2 обладает хорошей адсорбирующей способностью и применяется для очистки воздуха от вредных примесей.
Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ.
В медицине применяют некоторые соли марганца. Например, перманганат калия применяют как антисептическое средство в виде водного раствора, для промывания ран, полоскания горла, смазывания язв и ожогов. Раствор KMnO4 применяют и внутрь при некоторых случаях отравления алкалоидами и цианидами. Марганец является одним из активнейших микроэлементов и встречается почти во всех растительных и живых организмах. Он улучшает процессы кроветворения в организмах.
Марганцевыми удобрениями служат марганцевые шлаки, содержащие до 15% марганца, а также сернокислый марганец. Но наибольшее распространение получил марганизированный суперфосфат, содержащий около 2-3% марганца.
Микроудобрения применяют также в виде некорневых подкормок, опрыскивая растения соответствующим раствором или замачивая в нем семена перед посевом.
Соединения Марганца, применяемые во многих отраслях промышленности, могут оказывать токсическое действие на организм. Поступая в организм главным образом через дыхательные пути, Марганец накапливается в паренхиматозных органах (печень, селезенка), костях и мышцах и выводится медленно, в течение многих лет. Предельно допустимая концентрация соединений Марганец в воздухе - 0,3 мг/м3. При выраженных отравлениях наблюдается поражение нервной системы с характерным синдромом марганцевого паркинсонизма. Лечение: витаминотерапия, холинолитические средства и другие. Профилактика: соблюдение правил гигиены труда.
Цены на металлический марганец в слитках чистотой 95 % в 2006 году составили в среднем 2,5$ за кг. В 2010 году килограмм металла стоил уже 4-4,5$
В общей структуре потребления марганца свыше 90% его используется в черной металлургии при выплавке стали в виде различных марганцевых ферросплавов а также в виде металлического марганца технической чистоты (96-99% Мn). Средний расход марганца в черной металлургии составляет 7-9 кг на 1 т стали. Большое разнообразие марок сталей и сплавов обусловливает необходимость получения марганца и марганцевых ферросплавов широкого сортамента. Стандарт на металлический марганец и марганцевые сплавы основан на содержании углерода, и при этом низкоуглеродистые сплавы характеризуются и низким содержанием фосфора. Стандарт силикомарганца построен по содержанию кремния, и более богатые по кремнию сплавы характеризуются более низким содержанием углерода и фосфора. Жестко ограничивается содержание в ферромарганце фосфора и серы. Наиболее распространенными сплавами марганца являются следующие:
Ферромарганец:
углеродистый ферромарганец ФМн75 и ФМн78 (цифры в марке указывают процентное содержание марганца) содержит >70% Мn и < 7% С;
среднеуглеродистый ферромарганец ФМн1,0, ФМн1,5 и ФМн2,0 (цифры в марке указывают процентное содержание углерода) содержит > 85 % Мn и соответственно, < 1,0; 1,5 и 2,0 %С;
низкоуглеродистый ферромарганец ФМн 0,5 (> 85 %Мn, < 0,5 %С).
Силикомарганец марок СМн10, СМн14, СМн17, СМн20 и СМн26 (цифрами указано содержание кремния в процентах), содержание марганца в силикомарганце твердых марок > 60 %.
Металлический марганец - содержит 95,0--99.85 % Мn и 0,04--0,20 % С. Содержание фосфора < 0,01 % для Мр00 и Мр0 и 0,07 % для остальных марок. Выплавляется следующие марки металлического марганца:
Электротермический Мр2, Мр1, Мр1С;
Электролитический Мр0, Мр00.
Азотированный металлический марганец, содержащий 2-6% азота.
Ферромарганец применяется для раскисления кипящей и спокойной стали почти всех марок, а также для легирования некоторых марок специальной стали. Для раскисления кипящей стали используют углеродистый ферромарганец с обычным или пониженным содержанием кремния, для раскисления спокойной стали - углеродистый ферромарганец или силикомарганец. Специальную сталь легируют углеродистым или малоуглеродистым ферромарганцем или металлическим марганцем.
В медицине некоторые соли Марганца (например, KMnO4) применяют как дезинфицирующие средства.
Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца 3d 5 4s 2 .
Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колеблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца . Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город , расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.

При взаимодействии с воздушной средой происходит окисление марганца . Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца .
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.

При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца . Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического характера Mn5O8. Может рассматриваться как ортоманганит марганца . Не растворяется в H 2 O.

Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н 2 O образует марганцовую кислоту.

Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец , -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец . Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.

Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец . Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.

Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец , медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Также микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные характеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и .

Большой процент диоксида марганца потребляется для создания гальванических элементов. с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим характеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
- Обозначение - Mn (Manganese);
- Период - IV;
- Группа - 7 (VIIb);
- Атомная масса - 54,938046;
- Атомный номер - 25;
- Радиус атома = 127 пм;
- Ковалентный радиус = 117 пм;
- Распределение электронов - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ;
- t плавления = 1244°C;
- t кипения = 1962°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,55/1,60;
- Степень окисления: +7, +6, +5, +4, +3, +2, +1, 0;
- Плотность (н. у.) = 7,21 г/см 3 ;
- Молярный объем = 7,35 см 3 /моль.
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название "марганец" получил в начале 19 века (от немецкого Manganerz - марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
- пиролюзит - MnO 2 ·n H 2 O
- манганит - MnO(OH)
- марганцевый шпат - MnCO 3
- браунит - 3Mn 2 O 3 ·MnSiO 3

Рис. Строение атома марганца
.
Электронная конфигурация атома марганца - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C - MnO 2 ;
- 600°C - Mn 2 O 3 ;
- 950°C - Mn 3 O 4 ;
- 1300°C - MnO.
- мелкораздробленный марганец при нагревании реагирует с водой с выделением водорода:
Mn + 2H 2 O = Mn(OH) 2 + H 2 ; - марганец (порошок) при нагревании вступает в реакцию с азотом, углеродом, серой, фосфором:
Mn + S = MnS; - активно реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Mn + 2HCl = MnCl 2 + H 2 ; - реагирует с разбавленной азотной кислотой:
3Mn + 8HNO 3 = 3Mn(NO 3) 2 + 2NO + 4H 2 O.
Применение и получение марганца
Получение марганца:
- чистый марганец получают электролизом водных растворов MnSO 4 с добавкой (NH 4) 2 SO 4 при pH=8-8,5: анод - свинец; катод - нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO 2 = 3Mn + 2Al 2 O 3 ; - кремнийтермия:
Si + MnO 2 = Mn + SiO 2 .
- алюмотермия:
Применение марганца:
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O 2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин - сплав марганца с медью и никелем;
- ферромарганец - сплав марганца с железом;
- марганцевая бронза - сплав марганца с медью.
- Калия перманганат издавная используют в качестве антисепитческого средства, которое действует только на поверхности кожи и слизистых оболочек.
Биологическая роль марганца:
Марганец входит в десятку "металлов жизни", необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы - данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
Латинское название:
Permanganate potassium
Код АТХ:
D08AX06
Действующее вещество:
Permanganate potassium
Производитель:
Фармпрепарат, Россия
Условие отпуска из аптеки:
По рецепту
Марганцовокислую соль калия используют в медицине в качестве антисептического средства. Раствор обладает сильной окисляющей способностью, но применять его нужно осторожно, так как даже немного превышенная концентрация может вызвать ожог. Кроме лечебных целей препарат помогает в быту, подходит для борьбы с вредителями и болезнями растений. Для приготовления раствора, кристаллики опускают в воду, важно, чтобы они полностью исчезли, и жидкость приобрела необходимый оттенок (от бледно-розового до густо-фиолетового). При соединении со щелочью средство становится зеленым.
Показания
Калий марганцовокислый применяется в качестве дезинфектора при обработке поврежденных участков кожи, для профилактики инфицирования, при следующих заболеваниях и состояниях:
- Воспаления носоглотки и горла
- Стоматит, гингивит, пародонтоз
- Для урологических спринцеваний
- В гинекологии
- При отравлениях
- При расстройствах пищеварения (прием внутрь)
- Для обработки глаз после укусов насекомых
- Высыпания и диатез
- Опрелости
- Пролежни.
Состав
Марганцовокислая соль калия – это основное действующее вещество в чистой форме, без добавок и примесей.
Медикаментозные свойства Марганцовки
При соприкосновении с элементами органического типа марганцовка образует кислород. Оксид воссоздает целостные альбуминатные цепочки, за счет чего в низких концентрациях обеспечиваются свойства вяжущего характера, а в больших – обеззараживающий, антибактериальный и дезодорирующий эффект. Основная особенность заключается в нейтрализации ядов, поэтому средство показано при неопределенных отравлениях и токсичных инфекциях.
Проявляет окислительные свойства в наименьшей степени при соединении со щелочью, образуя раствор зеленого оттенка.
При наружном применении не абсорбируется в кровь. При попадании внутрь всасывается практически полностью, повышая количество ферментов метгемоглобинредуктазы. При соблюдении дозировки марганцовка полезна для лечения многих заболеваний.
Описание форм выпуска

Цена: Фл. 3г – 15-20 руб., Фл. 5г – 25-30 руб., Пакет 10 г № 8 – 400-430 руб.
Марганцовка представляет собой кристаллы темно-фиолетового, почти черного оттенка. После приготовления раствора они полностью поглощаются водой, образуя жидкость от бледно-розового до густого сиреневого цвета.
Вещество расфасовано в затемненные стеклянные бутылки по 3 и 5 г. Флакон закрыт резиновой пробкой и металлической или пластмассовой крышкой. В картонной коробке содержится 1 банка и инструкция. Этикетка и упаковка имеют идентичный бело-розовый оттенок.
Второй вариант – для применения в быту. Кристаллы 45% находятся в полиэтиленовых пакетах с внутренней алюминизированной защитой по 10 г. В упаковку входит 8 единиц.
Отпуск по рецепту связан с тем, что перманганат используют не только в медицине. Ее добавляют в качестве основного компонента в синтезе взрывчатых веществ и при производстве наркотиков.
Способы применения
Традиционно средством обрабатывают раны и ожоги. Для промывания, обработки и смазывания применяется раствор (0,1-0,5 %), кроме этого дозировку назначают по следующей схеме:
- Для полоскания рта и горла – 0,01 -0,2%
- При обработке язвенных образований – 1-4%
- При лечении заболеваний гинекологии, в урологии — 0,1 -0,3%.
Для каждого случая существуют свои особенности приготовления и приема состава, но только лечащий врач может объяснить, зачем нужна марганцовка, и как правильно ее использовать:
Способ применения при отравлении
Чтобы промыть желудок и нейтрализовать токсины перманганат разводят в небольшом количестве воды до состояния густого насыщенного оттенка. Полученный раствор процеживают, вливают в 5-10 л жидкости до получения бледного тона, дают выпить больному. При приеме внутрь смесь вызывает рвоту, лекарство можно принимать до выхода чистой воды. В более сильной концентрации марганцовка вредна, так как насыщенный состав приводит к ожогу пищеварительных органов.
Способ применения в гинекологии и урологии
Перманганат применяется для спринцевания инфицированных или воспаленных органов. Для этого требуется слабый раствор. Также можно делать ванночки – на 10 л воды засыпают около 1 г кристаллов. Курс лечения составляет 30 дней при условии использования 1 раз в неделю.
Также хорошо помогает при трещинах в анальном отверстии и геморрое. Средство быстро заживляет повреждения, снимает воспаление и боль.
Способ применения при стоматите
Слабый раствор бледно-розового тона подходит для полоскания ротовой полости. Необходимо проводить процедуры 3-4 раза в сутки до заживления язв.
Другие возможности использования
Марганцовка назначается при следующих состояниях:
- Чтобы избавиться от мозолей и натоптышей делают смесь 2-5 %, смачивают ватный диск, прикладывают к больному месту на 10-15 минут. Можно добавить морскую соль. Более насыщенная жидкость вредна для кожи.
- В педиатрической практике рекомендуется добавлять 1-2 крупинки в воду для купания новорожденных. Препарат способствует ускоренному заживлению пупка. Важно следить, чтобы в ванночке не было нерастворенных кристаллов.
- При дерматитах и кожных высыпаниях тело смазывают 2 % составом трижды в день.
- При опрелостях готовят 2% концентрацию, при пролежнях – 5 %, в тяжелых случаях обработку рекомендуется делать каждые три часа.
Использование при беременности
Марганцовкой можно обрабатывать поверхность кожи на любом сроке и в период кормления грудью.
Противопоказания
Не назначают перманганат при повышенной чувствительности. Нельзя проводить обработку при искусственном прерывании беременности, так как это часто приводит к кровотечениям и перфорации.
Сочетания с другими веществами и медикаментами
Препарат не совместим с рядом продуктов и лекарственных средств: углем, сахарозой, танинными веществами. При взаимодействии с быстроокисляемыми элементами кристаллы сильно нагреваются, что может привести к самовозгоранию.
Марганец активизирует щелочь в присутствии оксидов.
Побочные эффекты
Неправильно приготовленный раствор вызывает серьезный ожог. При нанесении на кожу происходит окрашивание от бледно-желтого до коричневого оттенка.
Передозировка
Симптомы превышения количества марганцовокислой соли калия выражаются отеком и болью в горле при лечении стоматита и промывании желудка, слизистая приобретает более темный тон. У больного начинается приступ удушья, судороги. При пониженном уровне кислотности слизистой можно развить большое содержание гемоглобина, что отразится на цвете эпидермиса. Критическая доза для детей составляет 3г, для взрослых – 0,5 г/ кг массы тела.
Лечение заключается в восполнении дефицита витаминов С и B6, хлорид метилтионий играет роль акцептора и поставщика водородных ионов, выполняет функции антитоксина при отравлениях.
Правила хранения
Препарат нужно хранить в тщательно закупоренных сосудах, далеко от детей. Порошок пригоден к использованию неограниченный период времени. Готовый раствор можно хранить до полугода.
Аналоги
Абсолютно идентичного средства не существует, но есть препараты, которые могут заменить марганцовку в медицине:
Асептолин
 Фармаком, Россия
Фармаком, Россия
Стоимость:
Фл 25 мл – 20-30 руб., 100 мл – 60-70 руб.
Препарат обладает антисептическим действием, тормозит активность большинства штаммов. Противомикробные свойства зависят от концентрации основного вещества глицеритана в растворе. Не всасывается при наружном использовании, не рекомендуется совмещать со щелочами.
Предназначен для обработки ран и повреждений эпидермиса, инфекциях и воспалениях. Подходит для применения в гинекологии и урологии, хирургии. Способ нанесения заключается в протирании кожи.
Раствор темного бордового оттенка, с содержанием глицерола и брусничного экстракта разлит в тонированные стеклянные флаконы, закупоренные пропиленовой пробкой и пластиковой крышкой. Имеет слабый специфический запах.
Достоинства:
- Подходит ля профилактики осложнений при выделении экссудата
- Приемлемая цена
Недостатки:
- Не назначают для лечения детей
- При попадании внутрь может вызвать тяжелые побочные эффекты
Фурацилин
 Химфармзавод. Россия
Химфармзавод. Россия
Стоимость:
таб. 0,02 г № 10 – 50-70 руб., Р-ор 0.067% 10 мл – 25-30 руб.
Антибактериальное и противогрибковое средство для внешнего использования. Благодаря своим свойствам, выделяет из клеток патогенов аминопроизводные вещества, вследствие чего разрушаются белковые связи. Прекращаются обменные процессы, приостанавливается рост, возбудитель погибает. Средство активно против грамположительных и отрицательных бактерий, некоторых вирусов и простейших. Резистентность к компонентам развивается медленно, не достигая пиковых степеней.
Предназначен для лечения ран, ожогов, пролежней. Подходит для полоскания при стоматите и обработке воспаленных участков уретральных и генитальных органов. Не назначается при дерматозах и кровотечениях.
Таблетки для приготовления раствора, как и жидкая форма имеют бледно-желтый оттенок, обладают специфическим вкусом. Вкладываются в бумажные или фольгированные блистеры по 10 штук. В белую картонную коробку входит 1 пластина и инструкция. Раствор разливают во флаконы из стекла с резиновой пробкой и алюминиевой крышкой с обжимом.
Достоинства:
- Низкая стоимость
- Возможность применения для детей
Недостатки:
- Может развиться дерматит
- Нельзя обрабатывать раны при кровотечениях
Минералы марганца, в частности пиролюзит, известны были еще в античные времена. Считали пиролюзит разновидностью магнитного железняка и использовали при варке стекла – для осветления. То, что минерал в отличие от настоящего магнитного железняка магнитом не притягивается, объясняли довольно занятно: полагали, что пиролюзит – минерал женского пола и к магниту равнодушен.
В 18-м веке марганец выделили в чистом виде. И сегодня мы поговрим о нем детально. Так, обсудим, вреден ли чем опасен марганец, где его можно купить, как получить марганец и подчиняется ли он ГОСТу.
Марганец относится к подобной группе 7 группы 4 периода. Элемент является распространенным – занимает 14 место.
Элемент относится к тяжелым металлам – атомная масса более 40. На воздухе пассивируется – покрывается плотной оксидной пленкой, препятствующей дальнейшей реакции с кислородом. Благодаря этой пленке в нормальных условиях малоактивен.
При нагревании марганец вступает в реакцию с множеством простых веществ, кислот и оснований, образуя соединения с самой разной степенью окисления: -1, -6, +2, +3, +4, +7. Металл относится к переходным, поэтому с равной легкостью проявляет и восстановительные, и окислительные свойства. С металлами, например, с , образует твердые растворы, не вступая в реакцию.
Данное видео расскажет о том, что такое марганец:
Особенности и отличия от других материалов
Марганец – серебристо-белый металл, плотный, твердый – , с необыкновенно сложной структурой. Последняя является причиной хрупкости вещества. Известны 4 модификации марганца. Сплавы с металлом позволяют стабилизировать любую из них и получить твердые растворы с очень разными свойствами.
- Марганец относится к числу жизненно важных микроэлементов. Причем в равной степени это относится и к растениям, и к животным. Элемент участвует в фотосинтезе, в процессе дыхания, активирует ряд ферментов, является непременным участником мышечного метаболизма и так далее. Суточная доза марганца для человека составляет 2– 9 мг. Одинаково опасен как недостаток, так и избыток элемента.
- Металл тяжелее и тверже железа, однако практического применения в чистом виде не имеет из-за высокой хрупкости. Но его сплавы и соединения имеют необыкновенно большое значение в народном хозяйстве. Он используется в черной и цветной металлургии, в производстве удобрений, в электротехнике, в тонком органическом синтезе и так далее.
- От металлов своей собственной подгруппы марганец довольно сильно отличается. Технеций – радиоактивный элемент, получен искусственно. Рений относит к рассеянным и редким элементам. Борий также может быть получен только искусственным путем и в природе не встречается. Химическая активность и технеция и рения намного ниже, чем у марганца. Практическое применение, если не считать ядерного синтеза, находит только марганец.
Марганец (фото)

Плюсы и минусы
Физические и химические свойства металла таковы, что на практике дело имеют не с самим марганцем, а с его многочисленными соединениями и сплавами, так что достоинства и недостатки материала стоит рассматривать с этой точки зрения.
- Марганец образует самые разнообразные сплавы практически со всеми металлами, что является несомненным плюсом.
- полностью взаиморастворимы, то есть, образуют твердые растворы с любым соотношением элементом, однородные по свойствам. При этом сплав будет иметь куда более низкую температуру кипения, чем у марганца.
- Наибольшее практическое значение имеют сплавы элемента с углеродом и . Оба сплава имеют огромное значение для сталелитейной промышленности.
- Многочисленные и разнообразные соединения марганца применяют в химической, текстильной, стекольной промышленности, при производстве удобрений и так далее. Основой такого разнообразия служит химическая активность вещества.
Недостатки металла связаны с особенностями его строения, не позволяющими использовать сам металл в качестве конструкционного материала.
- Главный из них – хрупкость при высокой твердости. Mn до +707 С кристаллизируется в структуре, где ячейка включает 58 атомов.
- Довольно высокая температура кипения, работать с металлом со столь высокими показателями тяжело.
- Электропроводность марганца очень низкая, так что применение его в электротехнике тоже ограничено.
Про химические и физические свойства марганца поговорим далее.
Свойства и характеристики
Физические характеристики металла заметно зависят от температуры. Учитывая наличие целых 4 модификаций это неудивительно.
Основные характеристики вещества таковы:
- плотность – при нормальной температуре составляет 7,45 г/куб. см. Именно эта величина слабо зависит от температуры: так, при нагревании до 600 С плотность уменьшается только на 7%;
- температура плавления – 1244 С;
- температура кипения – 2095 С;
- теплопроводность при 25 С составляет 66,57 Вт/(м·К), что для металла является низким показателем;
- удельная теплоемкость – 0,478 кДж/(кг·К);
- коэффициент линейного расширения, измеренный при 20 С, равен 22,3·10 -6 град -1 — ; Теплоемкость и теплопроводность вещества увеличиваются линейно при увеличении температуры;
- удельное электрическое сопротивление – 1,5– 2,6 мком·м, лишь немногим выше, чем у свинца.
Марганец является парамагнетиком, то есть, намагничивается во внешнем магнитном поле и притягивается к магниту. Металл переходит в антиферромагнитное состояние при низких температурах, причем температура перехода для каждой модификации разная.
Структура и состав марганца описаны ниже.
Марганец и его соединения — тема видеоролика ниже:
Структура и состав
Описаны 4 структурные модификации вещества, каждая из которых устойчива в определенном температурном интервале. Сплавление с определенными металлами может стабилизировать любую фазу.
- До 707 С устойчивой является а-модификация. – кубическая объемно-центрированная решетка, в состав элементарной ячейки которой входит 58 атомов. Такая структура очень сложна и обуславливает высокую хрупкость вещества. Его показатели – теплоемкость, теплопроводность, плотность, приводятся как свойства вещества.
- При 700–1079 С устойчивой является b-фаза с таким же типом решетки, но с более простым строением: ячейку составляет 20 атомов. В этой фазе марганец проявляет определенную пластичность. Плотность b-модификации – 7,26 г/куб. см. Фазу легко зафиксировать – закалкой вещества при температуре выше температуры фазового перехода.
- При температурах от 1079 С до 1143 С g-фаза стабильна. Для нее характерна кубическая гранецентрированная решетка с ячейкой из 4 атомов. Модификация отличается пластичностью. Однако зафиксировать фазу полностью при охлаждении не удается. При температуре перехода плотность металла составляет 6,37 г/куб. см, при нормальной – 7, 21 г/куб. см.
- Выше температуры 1143 С и до кипения стабилизируется d-фаза с объемно-центрированной кубической решеткой, ячейка которой включает 2 атома. Плотность модификации составляет 6,28 г/куб. см. Интересно то, что d-Mn может перейти в антиферромагнитное состояние при высокой температуре – 303 С.
Фазовые переходы имеют большое значение при получении разнообразных сплавов, тем более что физические характеристики структурных модификаций отличаются.
Производство марганца описано ниже.
Производство
 В основном , но встречаются и самостоятельные месторождения. Так, на территории чиатурского месторождения сконцентрировано до 40% мирового запаса марганцевых руд.
В основном , но встречаются и самостоятельные месторождения. Так, на территории чиатурского месторождения сконцентрировано до 40% мирового запаса марганцевых руд.
Элемент рассеян едва ли не во всех горных породах, легко вымывается. Содержание его в морской воде невелико, но на дне океанов он формирует вместе с железом конкреции, в которых содержания элемента достигает 45%. Эти залежи считают перспективными для дальнейшего разрабатывания.
На территории России крупных месторождений марганца мало, потому для РФ он является остродефицитным сырьем.
Самые известные минералы: пиролюзит, магнитит, браунит, марганцевый шпат и так далее. Содержание элемента в них варьируется от 62 до 69%. Добываются карьерным или шахтным способом. Как правило, руда предварительно обогащается.
Получение марганца напрямую связано с его применением. Главный его потребитель – сталелитейная промышленность, а для ее нужд требуется не сам металл, а его соединение с железом – ферромарганец. Поэтому говоря о получении марганца, зачастую имеют в виду соединение, необходимое в черной металлургии.
Ранее ферромарганец производился в доменных печах. Но из-за дефицита кокса и необходимости использовать бедные марганцовые руды производители перешли к выплавке в электропечах.
Для плавки используются открытые и закрытые печи, футерованные углем – таким образом получают углеродистый ферромарганец. Плавку производят при напряжении в 110–160 В, двумя методами – флюсовым и бесфлюсовым. Второй метод более экономичен, так как позволяет полнее извлечь элемент, однако при большом содержании кремнезема в руде, возможен только флюсовый способ.
- Бесфлюсовый метод – непрерывный процесс. Шихта из марганцевой руды, кокса и железной стружки загружается по мере переплавления. Важно следить за достаточным количеством восстановителя. Ферромарганец и шлак выпускаются одновременно 5–6 раз за смену.
- Силикомарганец производят сходным методом в электроплавильной печи. Шихта, кроме руды включает марганцевый шлак – без фосфора, кварцит и коксик.
- Металлический марганец получают аналогично выплавке ферромарганца. Сырьем служат отходы от разливки и разделки сплава. После расплавления сплава и шихты добавляют силикомарганец, а за 30 минут до окончания плавки продувают сжатым воздухом.
- Химически чистое вещество получают электролизом .
Применение
90% мировой добычи марганца уходит на нужды сталелитейной промышленности. Причем большинство металлов требуется не для получения собственно марганцевых сплавов, а для и включает 1% элемента. Более того, он может полностью заместить никель, если повысить его содержание до 4–16%. Дело в том, что марганец как и стабилизирует в стали фазу аустенита.
Марганец – металл, который интересен не столько сам по себе, сколько свойствами своих многочисленных соединений. Однако переоценить его значение в качестве легирующего элемента сложно.
Реакция оксида марганца с алюминием продемонстрирована в этом видео: